こんにちは!
安中市役所で献血してきた眼鏡Pです。
#色んなものをいっぱいいただきました笑
では、2022年栃木県公立高校入試問題の過去問の理科を「かいせつ」していきます。

理科3⃣(化学)
1 CO₂
うすい塩酸(HCl)と炭酸水素ナトリウム(NaHCO₃)が反応すると、二酸化炭素(CO₂)が発生する。なお、この反応では、塩化ナトリウム(NaCl)と水(H₂O)も生じる。
【化学反応式】
NaHCO₃ + HCl → NaCl + H₂O + CO₂
2
グラフ(下記参照)
発生する気体の質量・・・1.2g
反応後、ふたをゆるめる前の質量に対して、ふたをゆるめた後の質量が小さくなるのは、発生した気体が容器の外へ出ていくからである。よって、発生した気体の質量は、反応後にふたをゆるめる前の質量と、ふたをゆるめた後の質量の差として求めることができる。
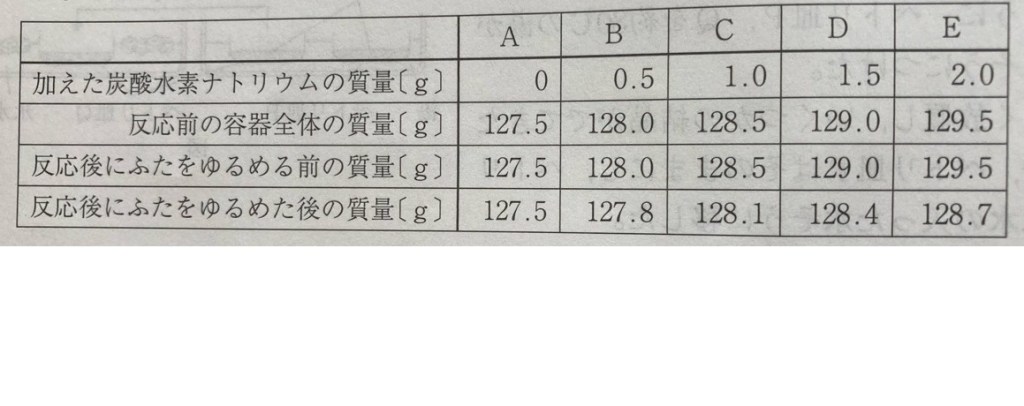
したがって、加えた炭酸水素ナトリウムの質量が0gのとき、発生した気体の質量は
127.5 − 127.5 = 0(g)
0.5gのとき、128.0 − 127.8 = 0.2(g)
1.0gのとき、128.5 − 128.1 = 0.4(g)
1.5gのとき、129.0 − 128.4 = 0.6(g)
2.0gのとき、129.5 − 128.7 = 0.8(g)
これらの値を点(・)などで印をつけてグラフをかくと、グラフは原点を通る直線になる。つまり、発生した気体の質量は、加えた炭酸水素ナトリウムの質量に比例する。

よって、炭酸水素ナトリウム1.0gから気体が0.4g発生したことから、炭酸水素ナトリウム3.0gで実験を行うとき、発生する気体の質量をx(g)とすると、
1.0:0.4=3.0:x
よって、約3倍になっているので、
0.4×3=1.2
発生する気体の質量 1.2g
3記号 ✕
理由(例)塩酸の濃度を変えても、加える炭酸水素ナトリウムの質量が同じであるため、発生する気体の質量は変わらないから。
2で求めたグラフより、加えた炭酸水素ナトリウムの質量と発生した気体の質量は比例していることから、加えた炭酸水素ナトリウムは、うすい塩酸とすべて反応していることがわかる。そのため、塩酸の濃度を濃くしても、加えた炭酸水素ナトリウムの質量が同じであれば、発生する気体の量は変わらない。
よって、結果は仮説のとおりにはならない。
※ちなみに濃くすると、
濃くしたところで質量は変化しないが反応が早くなったりはする。
以上になります。
※意味や画像などはWikipediaなど、さまざまなサイト様を参照しています。
本日もご覧くださり、ありがとうございました!
2022年 栃木県 公立高校入試問題 過去問 理科でした。次回からはこの続きを「かいせつ」していきます。
よろしくお願いいたします!
【学習塾トモニー】
塾のホームページが完成しました!もし興味がある方はぜひ、見ていただければと思います!完全自作になります!よろしくお願いいたします!